ORIGIN OF PHOTOSYNTHESIS AND ITS EVOLUTIONARY PROCESS
Satoshi Hanada
Institute for Biological Resources and Functions
National Institute of Advanced Industrial Science and Technology (AIST)
Tsukuba Central 6, 1-1-1 Higashi, Tsukuba 305-8566, Japan.
Tel: +81-29-861-6590 Fax: +81-29-861-6587
E-mail
(Received 18 August 2004 Accepted 12 November 2004)
(Abstract)
Cyanobacteria can oxidize water using light energy, and which causes evolving oxygen molecules. In the history of life on the Earth, the origin of cyanobacteria is not so old, and anoxygenic photosynthesis has been established prior to the first appearance of oxygenic photosynthesis. Such phototrophs that photosynthesize without oxygen production still survive up to now and frequently found in various environments. Anoxygenic photosynthetic bacteria are taxonomically divided into four groups: filamentous anoxygenic phototrophic bacteria (FAPB), purple bacteria (PB), green sulfur bacteria (GSB), and heliobacteria (HB). Cyanobacteria are known to use two different types of photopigment-containing protein complex, i.e., photosystem I (PS I) and photosystem II (PS II), in their oxygenic photosynthesis, whereas anoxygenic phototrophs possess only one of two photosystem-types. GSB and HB contain a PS I-type photosystem in their photosynthesis, while FAPB and PB contain a PS II-type photosystem. The phylogenetic analysis based on 16S rRNA sequence and comparison of the photochemical structure among the phototrophic bacteria suggested that the origin of anoxygenic photosynthesis is much older than that of oxygenic photosynthesis and a photosynthetic core complex in the first phototroph appeared to be similar to a PS II-type photosystem. In the evolutionary pathway of photosynthesis, a PS II-type phototroph emerged first, and then a PS I-type phototroph came out. Oxygenic photosynthesis that appeared subsequently to anoxygenic photosynthesis originated from genetic incorporation of these two different types of photosystems.(Keyword) photosynthesis, anoxygenic photosynthetic bacteria, cyanobacteria, oxygen evolution
光合成の出現と進化
花田 智 (産業技術総合研究所・生物機能工学研究部門) 独立行政法人 産業技術総合研究所(AIST) 生物機能工学研究部門
〒305-8566 茨城県つくば市東1-1-1 つくば第6事業所
1. はじめに
現在の大気の5分の1を占める酸素は,主にシアノバクテリアと呼ばれる酸素発生型の光合成細菌により生産されたものである.このような大量の酸素の発生が地球環境に与えた多大なる影響,生物全体に対するその功罪に関しては,今さら語るべくもないが,このシアノバクテリアによる酸素発生は光エネルギーを用いた水の分解(酸化)が原因となっている.つまり,電子供与体としての水から電子を引き抜くため,副産物(老廃物)として分子状酸素が生成してしまうわけである. 光合成機能の進化過程では,酸素発生型光合成の出現に先立って酸素の発生を伴わないタイプの光合成(非酸素発生型光合成)が存在したものと考えられている.シアノバクテリアが電子供与体として水を用いることが出来るのに対し,これら非酸素発生型光合成細菌は水を供与体とすることが出来ず,代わりに硫化水素等の還元的硫黄化合物や水素(または有機酸)などを使って光合成をする.このような非酸素発生型光合成を行う細菌も現存しており,それらは大きく以下の4つのグループに分けられている : 紅色光合成細菌(Purple bacteria),繊維状非酸素発生型光合成細菌(Filamentous anoxygenic phototrophic bacteria),緑色硫黄細菌(Green sulfur bacteria),ヘリオバクテリア(Heliobacteria). これら4種類の非酸素発生型光合成細菌はそれぞれ系統進化的に離れており,またシアノバクテリアからも隔たっている. 細菌の系統において,「非酸素発生型光合成細菌の4グループが広く分散していること」 と 「酸素発生型光合成細菌の存在が1グループに限定されているが散在していること」は,1)光合成機能は生命の進化のごく初期に獲得されたものであること, 2)酸素発生型光合成の起源はそれより遙かに新しく,それまでの古地球生態系では光依存型生物(phototrophs)はすべて非酸素発生型であり,そのような時代はかなり長く続いたことを強く示唆する.本論説では,細菌における光合成の根幹である光化学反応中心(本論では 単に光化学系photosystemと呼ぶ)の多様性とその起原,酸素発生型光合成の獲得に至る進化過程について論じるとともに,シアノバクテリア出現以前(分子状酸素がほとんど存在しなかった時代)の非酸素発生型光合成細菌が古地球環境に与えた影響やその役割について考察したい.
2.光合成細菌の分類
植物や藻類(緑藻や紅藻,褐藻など)は光合成に伴い酸素を発生する.この酸素発生型光合成は細胞内小器官である葉緑体(クロロプラスト)により行われている.光合成を行う真核生物すべての細胞内に存在する葉緑体はシアノバクテリア(藍色細菌:かつては藍藻と呼ばれていた)というバクテリアの祖先が遙か昔に細胞内共生したものだと考えられている[1].シアノバクテリアは原核生物の中で酸素発生型光合成を行う唯一の生物である.細菌の中にはこのような光合成とは異なり酸素の発生を伴わない光合成,すなわち「非酸素発生型光合成」を行う細菌が存在している.このような非酸素発生型光合成細菌は細菌系統の中に散在しており,以下の4つのグループに分かれている[2].1)繊維状非酸素発生型光合成細菌 (Filamentous anoxygenic phototrophic bacteria, FAPB):多細胞繊維状の形態を持つ光合成細菌であり,温泉や河川に生息している.また,海岸のタイドプールや高塩濃度の塩湖でもその存在が確認されている.光合成による生育だけではなく,有機物と酸素が存在する環境では酸素呼吸による生育も可能である.光合成色素としてバクテリオクロロフィル (Bchl) aを含み,光捕集のための補助色素としてBchl c (ものによりBchl dやe) を合わせ持つものが多い.系統としてはChloroflexi門に属している[3, 4]. 2)紅色光合成細菌(Purple bacteria):非酸素発生型光合成細菌の中で最も種数の多い分類群である.河川,湖水,海洋,土壌など様々な環境中に見られる.酸素に対して高い感受性を示すものも少なくないが,紅色非硫黄光合成細菌(Purple nonsulfur bacteria)に属する細菌の多くは酸素呼吸で生育出来る.光合成色素としてBchl aまたはBchl bを持っている.これらグループはすべてProteobacteria門に属している[5, 6]. 3)緑色硫黄細菌(Green sulfur bacteria):酸素に対し高い感受性を持つ扁性嫌気性の光合成細菌である.海洋・陸水双方に見られる.含有する光合成色素は先の繊維状非酸素発生型光合成細菌と類似しており,Bchl aと光捕集のための色素としてBchl c (やBchl d,e) を持っている.これらは緑色硫黄細菌のみで構成されたChlorobi門と呼ばれる系統分類門に属している[5, 7]. 4)ヘリオバクテリア(Heliobacteria):緑色硫黄細菌同様,酸素に高い感受性を持つ光合成細菌であり,主に土壌中で見つかる.光合成細菌の中で唯一スポア(胞子)の形成能を有しているグループであり,そのスポアは乾燥や熱に強い耐性を示す.主な光合成色素はBchl gと呼ばれるクロロフィルaに似た独特な色素である.系統的にはグラム陽性細菌であるChlostridiumなどが属するFirmicutes門に分類される[8, 9]. このように非酸素発生型光合成細菌は系統学的に門という大きな分類階級レベルで広く散在しているばかりでなく,大きな生理学的・形態学的多様性を持っている.これは酸素発生型光合成という機能がシアノバクテリアの中にのみ見出されるのと対照的である.このような系統進化学的知見から,酸素発生型光合成の出現に先立って非酸素発生型光合成が出現しており,且つ細菌における非酸素発生型光合成の獲得は生物史の中でも極めて古いイベントであることが示唆される.
3.酸素発生型光合成のメカニズム
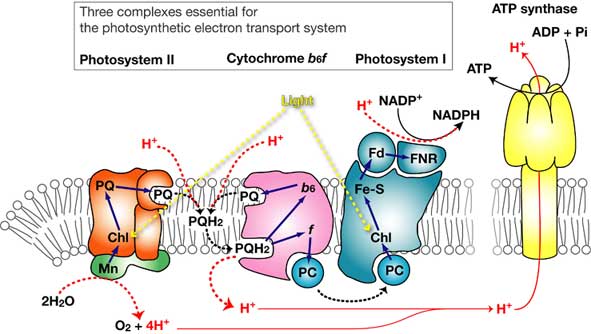
酸素発生型光合成は主に以下の3つの膜貫通型タンパク質により行われている.それは,光化学系II (PS II), Cytochrome b6f complex (Cyt b6f) そして光化学系I (PS I)である (Fig. 1 参照)[10, 11]. PS IIはクロロフィルを含む光駆動型の酵素であり,光のエネルギーを利用し水から電子を奪いプラストキノン(PQ)という脂溶性の電子運搬体に電子を渡す.このとき電子を奪われた水はプロトンと酸素原子に分かれる.2分子の水が4電子酸化されることにより1分子の分子状酸素が発生する.PS II内のPQは電子を受け取った事により水素イオン(プロトン)を膜外水相より捕獲し,膜中を移動して,Cyt b6fにたどり着く.PQはCyt b6fへ電子を受け渡すとともに,プロトンを(受け取ったのとは逆側の膜外へ)リリースする.Cyt b6fが受け取った電子はプラストシアニン(PC)という水溶性の電子運搬体に手渡され,PS Iへ運ばれる.PS IはPS II同様クロロフィルを含む光駆動型の酵素であり,光エネルギーを利用してPCから受け取った電子を電子補足力の弱いフェレドキシン(Fd)に渡す.そして還元されたFdがNADP+に電子を与え,NADPHが作られる.生成されたNADPHは還元力として炭酸固定や物質生産に用いられる.また,これら膜タンパク質間を電子が移動する間に膜を隔てた水素イオン(プロトン)の勾配が形成され,膜貫通型のATP合成酵素がこの勾配を利用しATPの生産を行う.このような還元力(NADPH)とエネルギー(ATP)の生産を行うために膜タンパク質が電子の受け渡しをするシステムを「電子伝達系」と呼ぶが,酸化還元ポテンシャルを縦軸として この電子の流れを描いたものがFig. 2である.電子は酸化還元ポテンシャルのマイナス側(図の上方)からプラス側(下方)へと授受されるが,その逆方向への移動にはエネルギーが必要とされる.酸素発生型光合成においては電子補足力の強い水(+820 mV)から電子補足力の弱いNADP(-320 mV)へ電子が受け渡される間に光による電子のポンプアップが二度行われている.この二度のポンプアップのために2種類の光化学系(PS IIとPS I)が関与しているのである.
4.非酸素発生型光合成細菌の光化学系
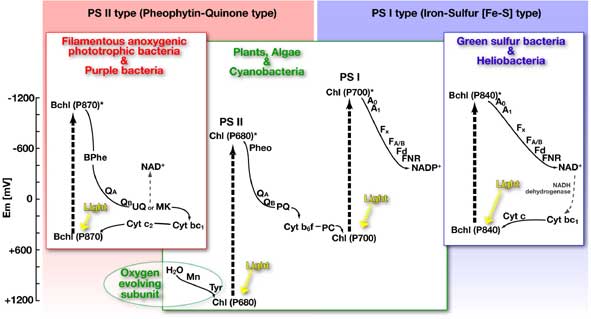
酸素発生型光合成細菌がPS IIとPS Iという2種類の光化学系を持っているのに対し,非酸素発生型光合成細菌はそのうちどちらか一方の光化学系しか持たない(Fig. 2 参照) [12].繊維状非酸素発生型光合成細菌と紅色光合成細菌はPS IIに類似した光化学系のみで光合成を行っており,緑色硫黄細菌とヘリオバクテリアはPS I類似の光化学系だけを持つ.光合成において2つの光化学系を合わせ持つ必要はなく,どちらか一方だけでもエネルギー(ATP)と還元力(非酸素発生型においてはNADH)の生産が十分に可能なのである.大きな違いは電子伝達の電子供与体として水を使うことが出来ないと言うことである.それが光合成において酸素の発生を伴わないことの理由であるが,非酸素発生型光合成細菌は電子供与体として水ではなく,硫化水素等の還元的硫黄化合物,水素,有機物などを用いる.酸素発生型光合成細菌であるシアノバクテリアのPS IIは水から電子を引き抜くために特別な構造体を発達させている[13]. それは4つのマンガン原子を含むユニットで,4電子酸化を受けている間の不完全な酸化状態におかれている水を安定化させるための構造であるとされている.繊維状非酸素発生型光合成細菌と紅色光合成細菌はPS IIに極めて類似した光化学系を持つが,酸素発生に関与するこのユニットを欠くため,水を電子供与体として利用出来ない[14, 15].他方,PS IはPS IIと比べて低い酸化還元電位に適応した光化学系であり,電位の低い鉄硫黄クラスター(Fe-S)を含みFdを経てNADを直接還元出来るという特徴を持つものである[16].このPS Iに類似した光化学系のみで光合成を行う緑色硫黄細菌やヘリオバクテリアは,その光化学系自体の酸化還元電位が低すぎて電子補足力の強い水から電子を引き抜くことは不可能で,水を電子供与体とすることは出来ない.
5.光化学系の進化
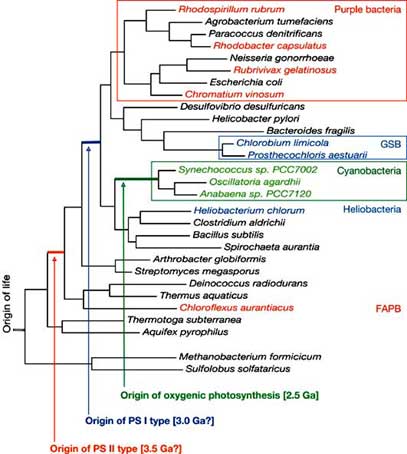
光合成の2型式(酸素発生型と非酸素発生型光合成)の明確な違いの一つは,酸素発生型光合成では二つの光化学系(PS IIとPS I)を用いるのに対し,非酸素発生型光合成ではそのどちらか一方しか用いないということである.つまり,シアノバクテリアが酸素発生という特別な機構を獲得するためには,一方だけでも光合成的に十分に生育可能な二つの光化学系を合わせ持つ必要があったのだろうと考えている.二つの光化学系は光エネルギーを利用し電子補足力の強いものから弱いものに電子を受け渡すといった機能から見れば同質であると言えるが,それらの酸化還元電位帯は異なっており,キノンの還元を行うPS IIが酸化的(酸化還元電位帯が高め)なのに対し,Fdを還元するPS Iは還元的(酸化還元電位帯が低め)な傾向を持っている.シアノバクテリアに見られるPS IIは,非酸素発生型細菌の持つ類似光化学系に比べ電子補足力が強くなっており,更にまた,マンガン原子を含む「酸素発生ユニット」は水から電子を引き抜くことが出来るまでになっている.このようなPS IIの電子受容側の高酸化還元電位方向へのシフトは,もう一つの光化学系を合わせ持っているという「エネルギー的なゆとり」が生み出した(発展的な)変化であると言えるかも知れない.Fig. 3は16S rRNA配列に基づいた各光合成細菌の系統進化的関係を表した系統樹である.酸素発生型光合成はシアノバクテリアの系統にしか見られないことから,このグループが分岐した以降に獲得されたものであると考えることができる.PS Iタイプの光化学系のみを持つ緑色硫黄細菌とヘリオバクテリアは系統樹上では離れて存在している.このことはPS Iタイプの光化学系が,これら両系統が分岐する以前に獲得されていたことを示唆する.また,PS IIタイプの光化学系のみを持つ繊維状非酸素発生型光合成細菌と紅色細菌は系統的に更に隔たっており,このタイプの光化学系(PS II)の起原がPS Iより古いことを示唆する.
このように16S rRNA配列に基づく解析では,酸素発生型光合成に先んじて非酸素発生型光合成が出現し,また光化学系の獲得順序はPS II ⇒ PS Iの順であったことが示される.他方,光化学系に含まれる色素(Bchl)の合成酵素のアミノ酸配列の比較解析[17, 18]や光合成細菌の全ゲノム配列を対象とした系統進化的研究[19]からは,ここで示した16S rRNA配列からの解析結果と異なる進化経路が示唆されることも多い.しかし,どの様な解析においても「非酸素発生型光合成は酸素発生型光合成に先行して獲得されていること」 と,「PS IIの起原はPS Iのそれよりも古い」という結果の得られることが多く,それらの結論は妥当なものであると言ってよいと考えている.
6.光合成の進化仮説
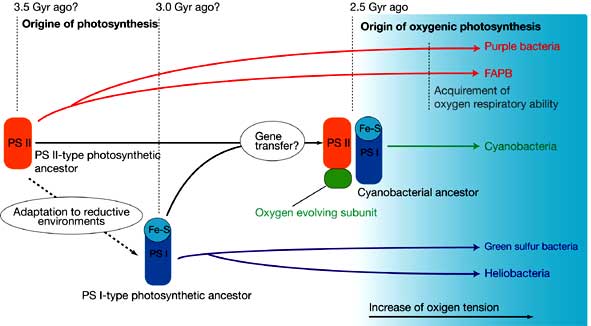
このような解析結果を踏まえて,光合成(光化学系)の進化過程を推定したものがFig. 4に示した進化仮説である:1)初期生命体における光合成機能の獲得
生命の歴史の初期の段階で光合成機能が開発されたであろうが,その光合成はPS IIタイプの光化学系を核としたものである.このPS IIタイプはキノンを含む酸化還元電位のあまり低くない光化学系であり,NADを直接還元出来ないことから,「エネルギー生産機能として十分であるが,洗練されていない光合成器官」であると言える.
2)環境により適応した光化学系の開発
やがて,PS Iタイプの光化学系が開発される.このPS IタイプはFdを経てNADを直接還元出来る低酸化還元電位型である.このタイプの光合成装置を持った生物は,酸素の存在しない嫌気的古地球環境において,生体物質生産のための還元力の生成と炭酸固定を効率のよく(電子伝達が滞る事なく)行うことが出来る.このようなことから,先に現れたPS IIタイプの光合成細菌に対し,その当時,圧倒的に優勢になったものと想像出来る.
3)酸素発生型光合成細菌の出現
古地球においては酸素発生を伴わない光合成を行う細菌の時代がかなり長きに渡り続いたものと考えられる.そして,今より25億年ほど前に初めて地球上に酸素発生型光合成が登場する.すなわち,シアノバクテリアの出現である.まずシアノバクテリアの祖先種の中で二種類の光化学系(PS IIとPS I)がひとつの細胞中に共存するといったイベントが起こったと考えられる.このハイブリッド化は,光合成遺伝子の伝搬によるものと考えられる.もともとPS IIタイプの光合成細菌にPS Iの遺伝子が伝搬したか,その逆であるのかは分からないが,結果としてひとつの細胞の中に2種類の光合成系が混在することになった(この時の遺伝子伝搬のメカニズムについて想像するより他にないが,光合成細菌が他種類の光合成細菌を細胞ごと取り込んだ事,すなわちPhagocytosis に端を発したのではないかと筆者は考えている.現存する細菌ではこのようなPhagocytosisはほとんど見られないが,光合成を行う真核生物である藻類においては藻類同士の「食い合い」が数多く報告されている.当然,真核生物と原核生物を同列に議論することは出来ないことは承知の上ではあるが・・・).最初,これら二つの光化学系はひとつの細胞内で独立に働いていたが,そのエネルギー的な余裕からか,PS IIの進化が大きく進むことになる.そして,4つのマンガン原子を含む酸素発生ユニットの獲得という第2のイベントが起こるのである.すなわち,これこそが酸素発生型光合成機構の完成であり,水を電子供与体として使用することの出来るシアノバクテリアの先祖型が出現することとなった.他方,非酸素発生型光合成細菌は,電子供与体として硫化水素など火山性の還元物質しか利用出来ないため,これが生育環境を限定することと繋がる可能性は大きい.しかし,シアノバクテリアはどこにでも存在する水を電子供与体として用いることが出来るため,地球上の様々な環境中で生育し得るようになった.水に加え,炭酸ガスと光があれば基本的に増殖可能であるため,シアノバクテリアは,地球表層部のほぼ全ての水圏に,その生育にとっての必要十分条件を見出せたにちがいない.こうして,シアノバクテリアの大繁殖が地球環境を変えるまでに広がっていくこととなった.
4)シアノバクテリアが非酸素発生型光合成細菌に及ぼした影響
シアノバクテリアは酸素発生型光合成という極めて経済的で効率的なエネルギー獲得手段を用いて,その数を増やしていった.その反面,廃棄物として大量の酸素が排出されるため,やがて地球規模での環境変化が引き起こされることとなる.排出された酸素は,当初,海水中に多量に含まれている還元鉄などの還元物質の酸化という形で処理されていたが,やがてそのリザーバーも底を尽き,大気中に溢れていくこととなる.そして,今より22億年から19億年前に大気中の酸素分圧が大きく上昇し,現在の15%に達するほどになった[20].地球環境はどんどん酸化的になっていき,嫌気的環境で進化してきた生物達すべてに深刻な悪影響を及ぼすこととなった.嫌気条件下で生きるものにとって酸素は強烈な酸化剤,すなわち毒,に過ぎないからだ.この被害は当然,非酸素発生型光合成細菌に及ぶ.彼らはみな酸素の影響の及ばない嫌気的環境へと追いやられることとなった.しかし,PS IIタイプの光合成細菌はその光合成装置がPS Iタイプのものにくらべ酸化的方向に寄っていたため,このような酸化的環境にある程度耐えることが出来た.さらには光合成電子伝達に関わっていたいくつかの酵素を流用して,最終的に酸素に電子を捨て,無毒な水へと還元する電子伝達系(すなわち酸素呼吸)を確立することに成功するものも現れた.これに対してPS Iタイプの光合成細菌は,その光合成装置が嫌気環境に完全に適応しており,酸素に対する極めて高い感受性を持つために酸化的環境では生育することは不可能であった.よって,酸素のある環境に順応出来ずに,嫌気的環境に留まり続け現在に至ることとなった.
7.非酸素発生型光合成細菌の古地球環境での役割
上に示した光合成の進化仮説は,光合成装置の分子構造・機構の比較および分子進化学的研究データに基づき,筆者が描く微生物世界に見られる光合成機能獲得の「シナリオ」である.この仮説の実証に関しては,当然,更なるデータの積み重ねと解析が必要とされるであろうし,また新たに得られた事実がこの仮説を根底から覆すこともあり得るだろう.しかし,「酸素発生型光合成の起原が比較的新しく,それに先行して非酸素発生型光合成が獲得されていた」ということは,疑いのない事実のひとつと筆者は考える.つまり酸素発生型光合成が出現する以前の地球では,非酸素発生型光合成細菌が何億年もの長きに渡り生存して(繁茂して)いたのである.では,古地球の微生物生態系において,これらの光合成細菌はどの様な役割を担っていたのであろうか.周知のことであるが,シアノバクテリアが登場する以前の地球環境には,分子状酸素はほとんど存在しなかった.このような嫌気的環境においては,硫化水素などの還元的物質は豊富に存在するが,その半面,酸化的な化合物の自然な合成や生態系への「酸化的物質」の供給はほとんど期待出来ない.生物はみな還元的物質を酸化することにより生きており,このような古地球環境は「餌」となる還元物質には事欠かないものであったろう.しかし,生物がエネルギーを得るためには,物質を酸化する際に生じる還元力の処理が必要となる.酸素呼吸においては酸素がその還元力の捨て鉢となる.嫌気環境に完全に適応している硫酸還元菌でさえ,還元力の処理のために「硫酸」という酸化的な物質を必要とする.酸素がほとんど存在しない古地球のような環境では,還元力を捨てるための「酸化的物質」が欠乏するのである.還元力の捨て鉢を豊富な二酸化炭酸に求めたメタン生成菌以外の生物は,「還元力の捨て鉢の欠乏」という問題に直面することとなる.また,還元力を基質の酸化中間物質に埋め戻す「発酵」というエネルギー生産系では,このような「還元力の捨て鉢」は必要ではないが,その発酵を支えるだけの基質の供給も電子伝達系と炭酸固定能を持った独立栄養生物,の存在抜きには考えられない.
非酸素発生型光合成細菌は,物質の酸化により得られた電子を光エネルギーを使って高エネルギー化し,より還元的な物質に受け渡すことが出来るので,この「還元力の捨て鉢の欠乏問題」からは解放されている.その上,光エネルギーで硫化水素や硫黄などを酸化して生きるので,硫酸などの酸化的硫黄化合物を多量に生成することになる.排出された硫酸は硫酸還元菌の「還元力の捨て鉢」として用いられていたのだろう.また,非酸素発生型光合成細菌は還元鉄を光合成基質として生きることも可能である.すなわち無酸素条件下で鉄の酸化を行う能力があると言うことである[21, 22].排出された酸化鉄は,それを「還元力の捨て鉢」として使用する生物(鉄還元菌)にとって役だったばかりでなく,海中に多量の鉄を沈殿させることになったはずである.これがシアノバクテリア出現以前(つまり酸素発生が始まる前)から縞状鉄鉱床と呼ばれる膨大な酸化鉄の鉱床が形成されていた原因であろう.
このように非酸素発生型光合成細菌は「酸化的物質」が欠乏していた古地球環境において,無酸素条件下での光による物質酸化を行い,当時の微生物生態系に「還元力の捨て鉢」を提供するという重要な役割を演じていたのであろう.逆に言えば,もし遙か昔に棲息した生命体=生物の体内で,「非酸素発生型光合成」という光エネルギーを利用した無酸素条件下での物質酸化システムの開発がなかったとしたら,物質循環システムは上手く機能せず,古地球の微生物生態系は非常に小さなものとなっていただろうし,現在に至る生命進化の道程は滞ってしまったはずである.
8.むすび:様々な視点での光合成進化仮説
地球生態系の発展と生物進化に光合成が果たした役割,そして与えた影響の大きさは計り知れないものがある.多くの研究者がこの極めて重要な機構の起原や進化に興味を示しており,様々な視点から光合成機能の進化過程が論じられている.そのような進化仮説の中から,いくつかの興味深い文献をピックアップし,文献リストの最後に加えておいた.本拙論を眺めて,未だ全容が明かとなっていない「光合成の進化」に関して,多少なりとも興味を持たれた読者は是非ともこれら優れた文献を手に取ってご覧頂きたい[23-27].引用文献
1. Margulis, L. Symbiotic Planet:: Basic Books Publishers, New York, 1998.2. Garrity, G. M. and Holt, J. G. The road map to the Manual: p. 119-155 In D. R. Boone, R. W. Castenholz and G. M. Garrity, (ed.), Bergey's Manual of Systematic Bacteriology, 2nd edn. vol. 1: Springer-Verlag, New York, 2001.
3. .Hanada, S. and Pierson, B. K. The Family Chloroflexaceae, In M. Dworkin, K. H. Schleifer and E. Stackebrandt, (ed.), The Prokaryotes: An Evolving Electronic Resource for the Microbiological Community, 3rd edition (release 3.11, November 22 2002): Springer-Verlag, New York, 2002.
4. Pierson, B. K. and Castenholz, R. W. Taxonomy and physiology of filamentous anoxygenic phototrophs, p. 31-47 InR. E. Blankenship, M. T. Madigan and C. E. Bauer, (ed.): Anoxygenic Photosynthetic Bacteria. Kluwer Academic Publishers, Dordrecht, 1995.
5. Imhoff, J. F. Taxonomy and physiology of phototrophic purple bacteria and green sulfur bacteria, p. 1-15 InR. E. Blankenship, M. T. Madigan and C. E. Bauer, (ed.), Anoxygenic Photosynthetic Bacteria: Kluwer Academic Publishers, Dordrecht, 1995.
6. Imhoff, J. F. The anoxygenic photorrophic purple bacteria, p. 631-637 InD. R. Boone, R. W. Castenholz and G. M. Garrity, (ed.), Bergey's Manual of Systematic Bacteriology, 2nd edn. vol. 1: Springer-Verlag, New York, 2001.
7. 0vermann, J. Family I. "Chlorobiaceae," Green Sulfur Bacteria, p. 601-623 InD. R. Boone, R. W. Castenholz and G. M. Garrity, (ed.), Bergey's Manual of Systematic Bacteriology, 2nd edn. vol. 1: Springer-Verlag, New York, 2001.
8. Madigan, M. T. and Ormerod, J. G. Taxonomy, physiology and ecology of Heliobacteria, p. 17-30 InR. E. Blankenship, M. T. Madigan and C. E. Bauer, (ed.), Anoxygenic Photosynthetic Bacteria: Kluwer Academic Publishers, Dordrecht, 1995.
9. Madigan, M. T. Family VI. "Heliobacteriaceae" Beer-Romero and Gest 1987,113, p. 625-630 InD. R. Boone, R. W. Castenholz and G. M. Garrity, (ed.), Bergey's Manual of Systematic Bacteriology, 2nd edn. vol. 1: Springer-Verlag, New York, 2001.
10. Clayton, R. K. Photosynthesis, Physical mechanisms and chemical patterns: Cambridge University Press, Cambridge, 1980.
11. Blankenship, R. E. and Prince, R. C. Excited-state redox potentials and Z scheme of photosynthesis, Trends Biochem. Sci. 10, 382-383 (1985).
12. Olson, J. M. and Pierson, B. K. Evolution of reaction centers in photosynthetic prokaryotes, International Review of Cytology 108, 209-248 (1987).
13. Dovindjee and Coleman, W. J. How plants make oxygen, Scientific American 262, 50-58 (1990).
14. Michel, H. and Deisenhofer, J. Relevance of the photosynthetic reaction center from purple bacteria to the structure of photosystem II, Biochemistry 27, 1-7 (1988). 15. Pierson, B. K. and Thornber, J. P. Isolation and spectral characterization of
photochemical reaction centers from the thermophilic green bacterium Chloroflexus aurantiacus strain J-10-fl, Proc. Natl. Acad. Sci. USA 80, 80-84 (1983).
16. Krauss, N., Hinrichs, W., Witt, I., Fromme, P., Pritzkow, W., Dauter, Z., Betzel, C., Wilson, K. S., Witt, H. T. and Saenger, W. 3-dimensional structure of system I of photosynthesis at 6 angstrom resolution, Nature 361, 326-331 (1993).
17. Xiong, J., Fischer, W. M., Inoue, K., Nakahara, M. and Bauer, C. E. Molecular evidence for the early evolution of photosynthesis, Science 289, 724-1730 (2000).
18. Garcia-Gil, L. J., Gich, F. B. and Fuentes-Garcia, X. A comparative study of bchG from green photosynthetic bacteria, Arch. Microbiol. 179, 108-115 (2003).
19. Raymond, J., Zhaxybayeva, O., Gogarten, J. P., Gerdes, S. Y. and Blankenship, R. E. Whole-genome analysis of photosynthetic prokaryotes, Science 298, 1616-1620 (2002).
20. Holland, H. D. Early Proterozoic atmospheric change, p. 237-244 InS. Bengston, (ed.), Early life on Earth: Columbia University Press, New York, 1994.
21. Ehrenreich, A. and Widdel, F. Anaerobic oxidation of ferrous iron by purple bacteria, a new-type of phototrophic metabolism, Appl. Environ. Microbiol. 60, 4517-4526 (1994).
22. Heising, S., Richter, L., Ludwig, W. and Schink, B. Chlorobium ferrooxidans sp nov., a phototrophic green sulfur bacterium that oxidizes ferrous iron in coculture with a "Geospirillum" sp strain, Arch. Microbiol. 172, 116-124 (1999).
23. Blankenship, R. E. Origin and early evolution of photosynthesis, Photosynth. Res. 33, 91-111 (1992).
24. Blankenship, R. E. The origin and evolution of oxygenic photosynthesis, TIBS 23, 94-97 (1998).
25. Lockhart, P. J., Steel, M. A. and Larkum, A. W. D. Gene duplication and the evolution of photosynthetic reaction center proteins, FEBS Letters 385, 193-196 (1996).
26. Xiong, J. and Bauer, C. E. Complex evolution of photosynthesis, Annual Review of Plant Biology 53, 503-521 (2002).
27. 松浦克美, 伊藤 繁 酸素大気と生命の星をもたらした光合成―その誕生と進化のシナリオ, 科学 68, 839-844 (1998).
28. Hasegawa, M. and Kishino, H. Accuracies of the simple methods for estimating the bootstrap probability of a maximumlikelihood tree, Mol Biol Evol 11, 142-145 (1994).